USO DE HIERRO CERO VALENTE PARA LA REMOCIÓN DE CROMO 6 EN SUELOS CONTAMINADOS
Juventino Lima Donis
Laboratorio: Ecosistemas Proyectos Ambientales S. A.
El término contaminación del suelo se refiere a la degradación del suelo, por la presencia de un químico o una sustancia fuera de sitio en una concentración más alta de lo normal que tiene efectos adversos sobre cualquier organismo al que no está destinado. Aunque la mayoría de los contaminantes tiene origen antropogénico, algunos contaminantes pueden ocurrir naturalmente en los suelos como componentes de minerales y pueden ser tóxicos en concentraciones altas. Con frecuencia, la contaminación del suelo no puede ser evaluada directamente o percibida visualmente, convirtiéndola en un peligro oculto.
La cantidad y diversidad de contaminantes se encuentra en constante incremento a causa del desarrollo agroquímico e industrial. Esta diversidad y la transformación en los suelos por la actividad biológica de los componentes orgánicos en diversos metabolitos, hacen que los estudios de suelos para identificar a los contaminantes sean complejos y costosos. Los efectos de la contaminación del suelo también dependen de las propiedades de éste, ya que controlan la movilidad, biodisponibilidad y tiempo de residencia de los contaminantes.
Desde la expansión urbana, el suelo ha sido utilizado como vertedero de desechos sólidos y líquidos. Se consideraba que una vez enterrados y fuera de la vista, los contaminantes no representarían riesgo alguno para la salud humana o el medio ambiente y que de alguna forma desaparecerían (1).
Efectos de la Contaminación del Suelo:
La presencia de contaminantes en un suelo supone la existencia de potenciales efectos nocivos para el hombre, la fauna en general y la vegetación. Estos efectos tóxicos dependerán de las características toxicológicas de cada contaminante y de la concentración del mismo. En general, la presencia de contaminantes en el suelo se refleja de forma directa sobre la vegetación llevándola a su degradación, a la reducción de las especies presentes, y también a la acumulación de contaminantes en los organismos que entren en contacto. En el hombre, los efectos se restringen a la ingestión y contacto dérmico, que en algunos casos ha desembocado en intoxicaciones por metales pesados y más fácilmente por compuestos orgánicos volátiles o semi volátiles.
El cambio del pH en suelos origina, gracias a la capacidad intercambiadora del medio edáfico, la liberación de iones, desplazándose hasta ser absorbidos en exceso por las raíces de las plantas o hasta llegar a los acuíferos subterráneos, en caso contrario se da una fuerte adsorción, fijando los metales a las arcillas presentes en el suelo afectando su movilidad o disponibilidad (2).
Otro proceso es el de la biometilización, que es un proceso por el cual reaccionan los iones metálicos y determinadas sustancias orgánicas naturales, cambiando radicalmente las propiedades físico-químicas del metal. Es el principal mecanismo de movilización natural de los cationes de metales pesados. Los metales que ofrecen más afinidad para este proceso son: mercurio, plomo, arsénico y cromo.
La capacidad de adsorción del suelo tiene un efecto importante en la biodisponibilidad de los metales pesados y los metaloides. La captación biológica de metales por la biota del suelo y las plantas ocurre sólo cuando los metales están en forma iónica. Muchos metales se presentan en formas catiónicas simples, pero algunos como el As y el Cr forman oxianiones más complejos. Los metales son adsorbidos sobre la superficie de materia orgánica muy fina en los suelos (humus), minerales de arcilla, oxihidróxidos de Fe, Mn y algunas sales poco solubles como el carbonato de calcio. (3).
Remediación de Suelos Contaminados:
En los últimos años se ha visto una gran expansión en el campo conocido como nanociencia, esta área de investigación abarca física, química, biología, ingeniería, medicina, ciencia de los materiales entre otras. La nanociencia se dirige a un gran número de temas; muchos de los cuales tienen gran potencial en aplicaciones tecnológicas. Así cuando el enfoque de la nanociencia se mueve desde la ciencia básica hasta la aplicación; es más común usar el término nanotecnología. Se define como nanociencia al estudio de fenómenos en la escala de 1-100 nm, mientras que la nanotecnología es la capacidad de crear, controlar y manipular objetos en esta escala, con el propósito de producir nuevos materiales con propiedades específicas.
La degradación de los recursos del suelo en todo el mundo tiene un impacto significativo en la productividad agrícola, la seguridad alimentaria y el bienestar humano y, por lo tanto, su remediación requiere atención inmediata. Además, la contaminación del suelo con metales pesados se suma a esta crisis mundial. La remediación por medio de la nanotecnología podría proporcionar una solución sostenible para revitalizar los suelos dañados (4).
Dentro de la nanotecnología adoptada para contrarrestar la contaminación en suelos podemos mencionar al Hierro de valencia cero. El Hierro Cero Valente (ZVI) son nanopartículas de hierro de alta calidad y pureza, con una gran capacidad para reaccionar, degradar, adsorber, o transformar una amplia gama de contaminantes en suelos y aguas subterráneas. Es utilizado en la remediación de suelos, tratamiento o acondicionamiento de aguas, barreras reactivas permeables y otras aplicaciones. Especialmente indicado para el tratamiento de disolventes clorados, metales pesados, cianuros y pesticidas (5).
Figura 1: Nanopartículas de hierro cero obtenidas por microscopía electrónica

El hierro Fe se mantiene estable en atmósfera seca y en agua libre de CO2. En otras condiciones el hierro se oxida a Fe2+ y Fe3+, formándose FeO, Fe3O4 y δ-Fe2O3, que son interconvertibles. La forma férrica (Fe3+) es muy propensa a sufrir hidrólisis dando lugar a un polímero insoluble de hidróxido de hierro. Las especies predominantes en solución acuosa son el Fe2+ y Fe3+ y los complejos orgánicos ferrosos y férricos. En condiciones aerobias y pH neutro las sales inorgánicas de hierro (III) son las especies más estables (6).
Estructura de Molécula de Hierro Cero Valente:
- Núcleo (nZVI): Es el núcleo quien proporciona la fuente de electrones para las reacciones, las nZVI son bastante reactivas en el agua y poseen excelentes propiedades para donar electrones. La estructura del núcleo tiene importantes implicaciones en la Química de nZVI.
- La envoltura o cascara: Proporciona el sitio para reacciones químicas complejas e interacciones electrostáticas. La naturaleza defectuosa y desordenada del óxido cáscara lo hace potencialmente más reactivo en comparación con un simple óxido pasivo. La cáscara exhibe menos contraste con el denso núcleo interior. La capa de óxido tiene también propiedades semiconductoras y por lo tanto la transferencia de carga es relativamente fácil debido al pequeño espesor y la presencia de sitios defectuosos. El pH es un factor importante en la velocidad de formación de ésta, pues en medios ácidos su formación será lenta.
Síntesis de Nanopartículas de Hierro Cero Valente:
Síntesis Verde: La biosíntesis de Nanopartículas metálicas es útil no sólo por su reducido impacto ambiental, en comparación con algunos de los métodos de producción fisicoquímicos, sino también porque puede usarse para producir grandes cantidades de nanopartículas que estén libres de contaminación y que tengan un tamaño y morfología mejor definidos que nanopartículas biosintéticas. Por otra parte, los extractos de plantas pueden actuar también tanto como agentes reductores como agentes estabilizantes en la síntesis de nanopartículas. La síntesis verde de NP de Fe implica el uso de extractos de plantas utilizadas para el consumo humano tales como el: té, sorgo, eucalipto, Jacinto de agua, cebada, el bálsamo de limón (Melissa officinalis), el perejil (Crispum crispum), el salvado de sorgo (Sorghum spp.), el café, el té verde y el eucalipto(Eucaliptus). Los extractos de estas plantas contienen moléculas alcohólicas, principalmente de tipo fenólico, azúcares reductores, ácidos ascórbicos, flavonoides, aminoácidos proteicos que pueden ser explotados para la reducción, así como la formación de complejos estables con hierro (7).
Síntesis a Partir del Precursor Fe[N(Si Me3)2]2: Es otra alternativa en la síntesis de ZVI es a partir de métodos químicos en solución, obteniendo materiales con buenas características. En la síntesis de nanopartículas de Fe cero valente usando precursores organometálicos, se ha reportado la obtención de nanopartículas con una morfología cúbica con tamaños promedio de 7nm en las aristas, a partir de la reacción: Fe[N(SiMe3)2]2 + H2 −−−→ Fe + 2HN(SiMe3)2.
Durante el proceso de la reacción, se da la reducción de la amida de Fe (II) en solución con mesitileno a una temperatura de 150 °C en presencia de hexadecilamina y ácidos carboxílicos de cadena larga (8).
Toxicidad del Cromo Hexavalente:
El Cromo hexavalente es una especie toxica que induce dermatitis y tiene un efecto mutagénico y carcinógeno, afectando hígado, pulmones y riñones. Su naturaleza toxica es atribuida a su potencial de oxidación y su relativo pequeño tamaño, lo que le permite penetrar membranas biológicas bajo la forma de Cromato o Dicromato y oxidarlas. Los aniones tóxicos del Cromo (VI) son: 𝐶𝑟𝑂4 −2, 𝐻𝐶𝑟𝑂4 − 𝑦 𝐶𝑟2𝑂7 −2 son fácilmente introducidos por la célula a través de transportadores aniónicos, y reducidos por una gran variedad de reductores químicos y enzimáticos.
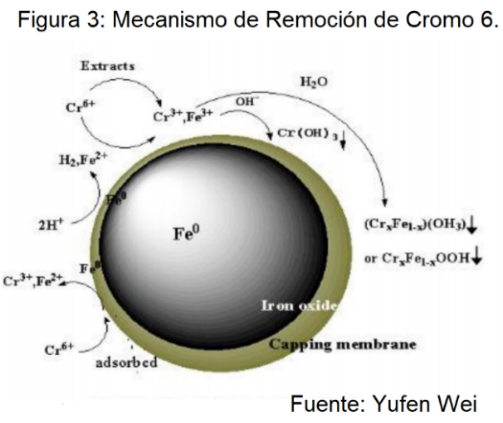
Remoción del Cromo 6 Utilizando Nanopartículas de Hierro Cero Valente:
En los suelos, el cromo puede existir en dos estados redox diferentes: la forma trivalente inmóvil, Cr (III); y forma hexavalente más móvil, Cr (VI) como cromato (CrO42−) o dicromato (Cr2O72−). El Cr (III) es un nutriente de baja toxicidad para el crecimiento de las plantas, mientras que el Cr (VI) es una especie peligrosa, mutagénica y cancerígena.
Adsorción: Una de las vías más importantes de eliminación de estos contaminantes es la adsorción, que constituye en un proceso de eliminación de una sustancia (adsorbato) presente en una fase líquida o gaseosa, por adhesión a la superficie de una fase sólida (adsorbente o sustrato). Esta adhesión puede ser producto del establecimiento de interacciones débiles de Van der Waals (fisisorción) o de la formación de enlaces químicos (quimisorción) entre adsorbato y adsorbente. El adsorbato se fija en la superficie del adsorbente o sustrato, estableciéndose un equilibrio adsorción-desorción:
A (adsorbato) + S (adsorbente o sustrato) ↔ AS
(Cromo hexavalente) + nZVI ↔ Equilibrio adsorción- desorción
A la cantidad de adsorbato que permanece adsorbido en el equilibrio en una determinada cantidad de adsorbente se le denomina (q), expresada generalmente en mg/g. La q es mayor cuanto mayor sea la superficie del sustrato y mayor la concentración de adsorbato mientras no se produzca la saturación del adsorbente.
Reducción: Se produce predominantemente con la utilización de hierro cero-Valente (ZVI) al ser un material con alto poder reductor, presentando el hierro un potencial redox de Eº Fe (II)/ Feº = – 0.440 V.
El hierro metálico actúa como agente reductor frente al cromo VI y la reacción se llevará a cabo como se muestra en la siguiente ecuación:
Cr2O7 2- (aq) + Fe0 (s)+ 28 H+ (aq) → 4Cr+3(aq) + 6Fe+2(aq) +14 H2O
Cr2O7 2- (aq) + 6 Fe+2 + 14 H+ (Aq) → 2 Cr+3 (Aq)+ 6Fe+3(Aq) + 7 H2O
Cr2O7 2- (aq) + 2 Fe0 + 14 H+ (Aq) → 2 Cr+3 (Aq)+ 2Fe+3(Aq) + 7 H2O
El Cr+3 y el Fe+3 resultante puede ser fijado por las arcillas o a veces se lixivia al subsuelo llegando a mantos acuíferos, pero ya no representan un riesgo como contaminante (9).
Para calcular el % de eliminación conforme pasa el tiempo se variará la concentración de cromo hexavalente donde él % de remoción será calculada por:
Eficiencia de remoción de Cr +6
%𝑅𝐸𝑀𝑂𝐶𝐼Ó𝑁 = 𝐶o − ∗ 100
Co
Donde:
C0 = concentración del cromo VI antes de la adsorción (g/l).
C = concentración de cromo VI después de la adsorción (g/l).
La cantidad adsorbida de cromo VI (mg de cromo VI/g de Nanopartículas) se determina mediante el balance de masa mostrado en la siguiente ecuación:
Cantidad adsorbida de Cr +6 𝑞𝑒 = (𝐶𝑂 − 𝐶) ∗ 𝑉
𝑀
Donde:
qe = Capacidad de Absorción en el equilibrio (mg⁄g).
C0, C = Concentración inicial y final de cromo VI en el equilibrio (mg /l).
V = Volumen de la solución (l).
M = Masa del adsorbente(nZVI) usado (g).
La utilización de nanopartículas de Hierro cero valente (nZVI) resulta de gran utilidad para inmovilizar in situ Cromo 6 en suelo reduciendo su movilidad y biodisponibilidad, con una eficacia de hasta el 92.9 % (según estudios realizados); sin impactar negativamente en las propiedades fisicoquímicas y en la fitotoxicidad del suelo.
Actualmente la nanotecnología resulta de difícil acceso y alto costo económico en Guatemala, pero en el caso del Hierro Cero Valente se puede optar por nanopartículas sintetizadas mediante una reacción redox, usando polifenoles de plantas y FeCl3 como agentes precursores, que resulta ser un método más accesible y económicamente más factible.
Teniendo en cuenta estos factores se puede concluir que el empleo de nZVI para la inmovilización de Cr 6, se ve como un método prometedor para la remediación de suelos contaminados con este metal y por lo tanto resulta viable el interés en su estudio y uso según las condiciones de nuestro país. El uso de la nanotecnología se puede considerar como una estrategia clave para mejorar las condiciones ambientales, asociadas a la contaminación de suelo y agua para Guatemala.
La ubicación geográfica de nuestro país permite ser un buen enlace con mercados internacionales, y por esta razón se convierten en una opción donde las empresas puedan invertir en este tipo de tecnología. Resulta de vital importancia la integración de diversos sectores: industria, academia y gobierno, para poder capacitar personal, invertir en infraestructura y equipos que nos permitan trabajar con tecnologías convergentes enfocadas a resolver parte de la problemática nacional.
Bibliografía:
- FAO y GTIS. 2015. Estado Mundial del Recurso Suelo (EMRS) – Resumen Técnico. Roma, Italia. FAO y Grupo Técnico Intergubernamental del Suelo. Consultado 27 de jul2021. Disponible en http://www.fao.org/3/i5126s/i5126s.pdf.
- Grau, M. Ríos, M. 2010. Riesgos Ambientales en la Industria. Madrid, España. UNED. 368p.
- Morgan, R. 2013. Soil, heavy metals, and human health. Soils and human health (en línea). Consultado el 28 de jul2021. Disponible en https://www.researchgate.net/publication/262805441SoilHeavyMetalsandHumanHealth
- Mendoza, G. La nanociencia y la nanotecnología: una revolución en curso, Facultad Latinoamericana de Ciencias Sociales (en línea). Consultado 3 de ago2021. Disponible en https://www.redalyc.org/pdf/115/11502906.pdf
- Grijalbo, L. 2016. Elaboración de Inventarios de Focos Contaminantes (en línea). Consultado 28 de jul2021. Disponible enhttps://books.google.es/books?id=pJ8mDAAAQBAJ&pg=PA273&dq=biometilizaci%C3%B3n&hl= en&sa =X&ved = 0ahUKEwil6WPtP7RAhVLXhoKHUypCL0Q6AEIHDAA#v=onepage&q=biometilizaci%C3%B3n&f=fals
- Fernández L. Rojas, N. Roldán, T. Ramírez, M. Zegarra, H. 2006. Manual de técnicas de análisis de suelos aplicadas a la remediación de sitios contaminados. SEMARNAT, INE, IMP. México, D.F. Editorial del Deporte Mexicano. 182p.
- Mystrioti, C. Xanthopoulou, T. Papassiopi, N. Xenidis, A. 2016. Comparative evaluation of five plant extracts and juices for nanoiron synthesis and application for hexavalent chromium reduction (en línea). Consultado 28 de jul2021. Disponible en https://www.sciencedirect.com /science /article /abs/pii/S00489697 15305 945
- Dumestre, F.; Chaudret, B.; Amiens, C.; Renaud, P.; Fejes, P. 2004. Superlattices of iron nanocubes synthesized from Fe[N(SiMe3)2]2 (en línea). Consultado 2 ago2021. Disponible en https://www.science.org/lookup/doi/10.1126/science.1092641
- Calder, L. 1988. Chromium Contamination of Groundwater In: Chromium in the Natural and Human Environments (en línea). Consultado 2 ago2021. Disponible en https://books.google.com.gt/books?hl=es&lr=&id=DVdCqL9NbOcC&oi=fnd&pg=PA215&dq=Calder,+L.+1988.+Chromium+Contamination+of+Groundwater&ots=ejzWLOfm1Z&sig=RtcUeMAVHTKqyHeCuusjUfZXi1c#v=onepage&q=Calder%2C%20L.%201988.%20Chromium%20Contamination%20of%20Groundwater&f=false
- Crédito fotografía portada: https://www.pexels.com/ Sharda.ac.in
Este artículo fue publicado en la revista de RELABSA









