Los efectos de los volcanes en la química atmosférica
William Quiroa
Ecosistemas Proyectos Ambientales S.A.
La atmosfera se considera un sistema químico oxidante, debido a la presencia de las diversas formas de oxígeno (O2, O3, entre otros). En comparación el ambiente volcánico tiene niveles de oxígeno bajo, Esto implica que el azufre que se libera por parte de un volcán y que está siendo emitido hacia la atmosfera dará lugar a la formación de sulfato. Del mismo caso todos los compuestos de carbono gaseoso terminaran como dióxido de carbono, a menos de que estos hayan quedado depositados ya sea como un depósito seco dispersado hacia el suelo o haya sido atrapado por partículas atmosféricas (aerosol o gotas del cielo), las cuales se depositan también hacia el suelo. El compuesto oxidante principal que se encuentra en la atmosfera es el radical hidroxilo (OH), el cual es producido a partir de la reacción de fotolisis de ozono (O3) y la reacción del átomo excitado de oxígeno (O) obtenido con vapor de agua:
O3 + luz ultravioleta O2 + O
O + H2O 2OH
El papel del ozono en la química atmosférica es variado, con efectos positivos y negativos en las cuales este compuesto ha recibido tanta atención. Además de ser el reactivo precursor para la formación del radical hidroxilo, actúa también como un escudo de radiación ultravioleta en la estratosfera. El ozono en concentraciones altas es un peligro para la salud humana y la vegetación; a nivel de la troposfera actúa como un gas de efecto invernadero. En la estratosfera, existe todavía radiación ultravioleta disponible para realizar la fotolisis del oxígeno molecular. Los átomos de oxígeno resultante pueden reaccionar con moléculas de oxígeno para producir ozono. Sin embargo, la única fuente que produce ozono en la troposfera es la reacción de fotolisis del dióxido de nitrógeno (NO2).
NO2 + hv NO + O
O + O2 O3
Siendo O, la molécula de oxígeno excitada por el proceso fotolítico del NO2.

La atmosfera no solamente es una gran cámara de reacción, también es un medio que promueve el transporte de gases y partículas. Las regiones de la atmosfera en donde las emisiones volcánicas pueden tener gran relevancia son la troposfera y la estratosfera. La troposfera cubre los 10 km de menor altitud y en este lugar es donde suceden todos los fenómenos climáticos. La troposfera esta cubierta por una capa de inversión muy fuerte de alta temperatura llamada la tropopausa. Por encima de la tropopausa se encuentra la estratosfera en la cual alcanza casi los 50 km de altitud. La parte más baja de 1 km de altitud se le conoce como la capa fronteriza, esta se encuentra en contacto directo con la superficie.
Las erupciones volcánicas son una fuerte y visible manifestación de la dinámica interna de la tierra sólida. Una fuerte característica es la emisión hacia la atmosfera de largas cantidades de partículas solidas (ceniza) y substancias gaseosas en un periodo corto de tiempo.
Las emisiones gaseosas consisten principalmente de vapor de agua, dióxido de carbono y compuestos de azufre reducidos (principalmente SO2), nitrógeno y compuestos halogenados. Estos se convierten en constituyentes de la atmosfera y sus tiempos de residencia en la atmosfera están sujetos a los ciclos biogeoquímicos de los elementos (oxigeno, carbono y azufre). La composición química de los gases volcánicos dependerá fuertemente de la química del magma y los flujos con el que se desplazaran varían substancialmente, dependiendo del estado de erupción o desgasificación del volcán.
Los compuestos volátiles volcánicos se forman rápidamente y se diluyen a una razón de 1:100 o 1:10000 debido a la mezcla de ellos con el aire del ambiente. Para volcanes inactivos, su proceso de desgasificación ha ocurrido con frecuencia por el tiempo en que la pluma volcánica (columna de ceniza) llega a alcanzar el cráter. La concentración absoluta de una determinada especie volcánica difiere entre diversos tipos volcanes, así como los estados (o formas) de erupción, el flujo total de los volátiles volcánicos, así como el tiempo que se lleva para que se disperse en la atmosfera.
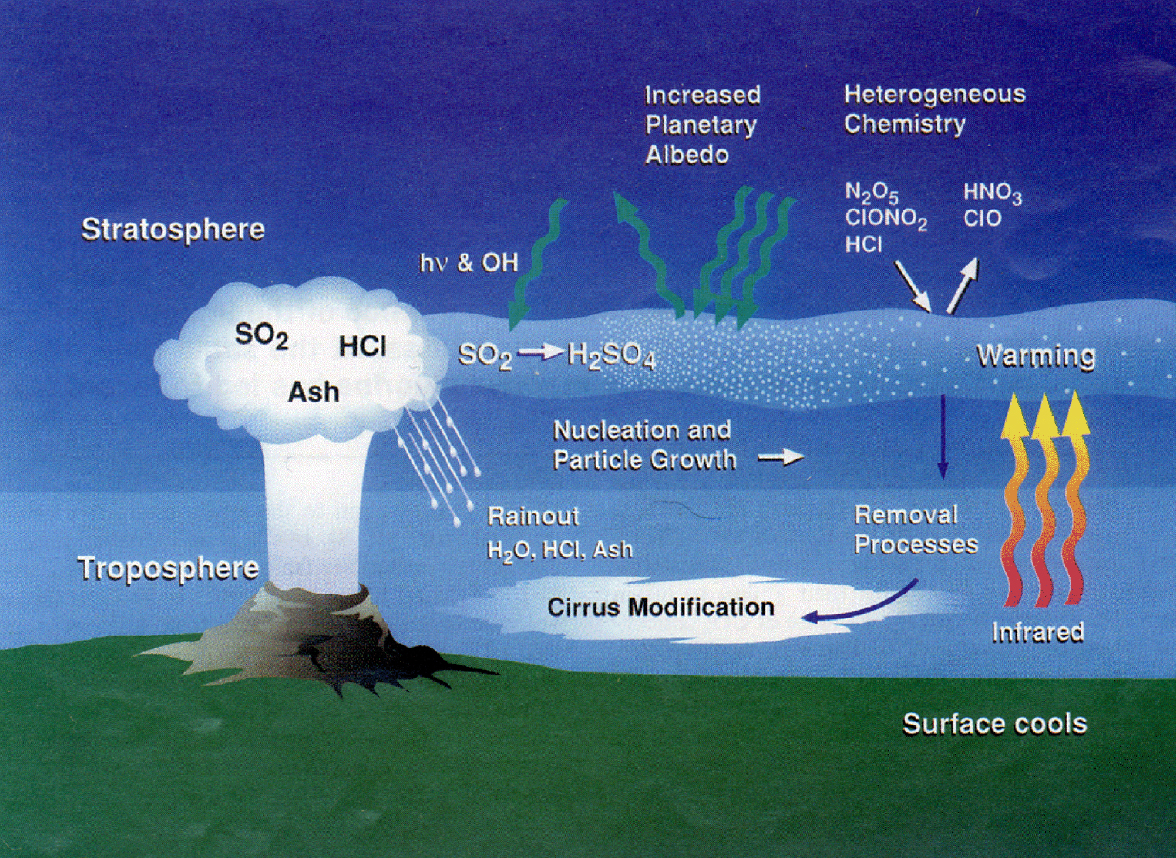
Las fuertes erupciones explosivas pueden penetran la estratosfera, el cual tiene un impacto directo no solo en la química estratosférica, sino también en el cambio climático. Se estima que estos pueden ocurrir en cada 5.5 años, los cuales inyectan vasta cantidad de ceniza, así como azufre en forma de partículas y SO2, la cual se oxida en la estratosfera a sulfato (SO4-2). El azufre volcánico junto con otros compuestos no volcánicos como el sulfuro de carbonilo COS, forman la base de la llamada Capa de Junge. Esta es una capa de aerosol global de aproximadamente 20 km de altitud que refleja la luz del sol, por lo tanto, lidera el enfriamiento a la atmosfera baja, pero también al calentamiento local debido a su absorción de luz solar. Las partículas de aerosol contenidas en ellas también proveen una superficie para que puedan ocurrir diversas reacciones químicas. Muchas de esas reacciones entre dos o más fases, involucran el desgaste en la capa de ozono estratosférico. Esto resulto en un calentamiento de aproximadamente 1.5°C en la estratosfera, debido a la absorción de la luz solar en la capa de aerosol.
En la atmosfera, el SO2 proveniente de los volcanes y otras fuentes es convertido a H2SO4 el cual es químicamente estable, o en sulfato. La conversión es muy rápida en la troposfera, el SO2 es convertido a ácido sulfúrico en un tiempo de varios días, mientras la conversión en la estratosfera puede tomar algunas semanas o meses. El ácido sulfúrico es altamente higroscópico y existe como ácido sulfúrico hidratado (H2SO4*H2O) o en aerosol de ácido sulfúrico. Estas especies se dispersan eficientemente en la parte visible del espectro solar, y su presencia aumenta la profundidad óptica de la atmosfera. Estas interactúan con la radiación solar que ocurre desde el espacio y desde la superficie de la tierra. El efecto de los aerosoles es la reducción de energía recibida cerca de la superficie, el impacto climático más significativo es el enfriamiento sobre la superficie y sobre la troposfera baja. Se ha mostrado que el aerosol de sulfato se emite directamente desde los volcanes o son rápidamente formados desde la pluma volcánica, en donde ya son detectables en el cráter.

Todo el sulfuro eventualmente terminará como sulfato a menos de que haya sido previamente depositado hacia la tierra. En la fase gaseosa la oxidación de SO2 por OH a H2SO4 es lenta, y ocurre en una escala de tiempo de cerca de 2 semanas en la troposfera. Una vez se forma el ácido sulfúrico en fase gaseosa, se vuelve un compuesto muy eficiente tomando el aerosol y las partículas de las nubes. El tiempo de vida atmosférica del H2S tomando en cuenta la reacción del radical OH es de aproximadamente 70 horas, pero es más corto en presencia de halógenos. La oxidación de sulfuro de carbono CS2 por los radicales OH lidera predominantemente a la forma de sulfuro de carbonilo (COS), su tiempo de vida en la atmosfera es de aproximadamente 120 horas. El COS es una fuente importante de azufre en la capa Junge estratosférica. Esto se debe a la extremada baja reactividad del COS en la troposfera, pero reacciona fotolíticamente de forma rápida en la estratosfera. Se piensa que los volcanes son responsables de cerca del 10% de las emisiones de SO2 globales y cerca del 20% en las emisiones de SO2 naturales. La actividad explosiva y eruptiva fue estimada de ser la responsable de cerca del 60% del SO2 volcánico y el 40% se debe a desgasificación.
Los flujos volcánicos de los gases HCl, HF y de HBr son muy largos, esto fue asumido de que estos gases se pudieran comportar de forma pasiva y son principalmente importantes para la acidez de la atmosfera y posiblemente para la química estratosférica. En general se pensó que la química en las plumas volcánicas fue restringido solamente a la oxidación de azufre. Esto cambio drásticamente con la detección del radical del oxido de bromo (BrO). Un paso clave en este mecanismo es la toma de bromo desde la fase gaseosa en sus dos formas acidas HOBr y HBr a las partículas aéreas, una reacción catalizada por acido en la fase acuosa y la liberación de radicales bromos (Br) de regreso a la fase gaseosa donde reacciona fotolíticamente rápido. Los radicales bromo resultantes reaccionan con ozono produciendo BrO.
Después de la erupción del volcán Pinatubo en 1980 el aerosol volcánico fue transportado a latitudes altas, donde se dio una superficie reactiva para que se obtuvieran las reacciones de cloro para la destrucción de ozono, estas son responsables de los llamados “agujeros de ozono”.
La magnitud del ingreso de halógenos volcánico (principalmente HCl) hacia la estratosfera es menor del 1% del HCl emitido, debido a una eficiencia en el proceso de remoción por medio de precipitación, sin embargo, se puede emitir más del 25% de HCl por los volcanes los cuales pueden alcanzar la estratosfera mediante partículas de hielo que son formadas en las plumas volcánicas.
Un efecto principal de los aerosoles estratosféricos mejoradas es en el cambio en la química del nitrógeno hacia un aumento de especies en reserva como lo es el ácido nítrico, a expensas de sus formas reactivas (los óxidos de nitrógeno, NOx). Esta remoción de NOx estratosférico tiene el efecto de debilitar el sistema de cloro en la atmosfera, debido a la eficiencia de la reacción:
ClO + NO2 ClONO2
El cual promueve un cambio relativo de la especie de cloro en reserva (ClONO2) a una especie de cloro activa (ClO). Una reacción adicional que puede ocurrir en presencia de HCl volcánico en estado gaseoso es:
ClONO2 + HCl Cl2 + HNO3
En la cual seguida de una fotólisis rápida de Cl2, vuelve a activar la producción de Cl radical. Los niveles mejorados de radicales Cl se encuentran implicados en la perdida de ozono producida por erupciones volcánicas de larga escala, de acuerdo a la siguiente reacción:
Cl + O Cl + O2
y
Cl + O3 ClO + O2
El cloro formado en la estratosfera es determinado por las emisiones antropogénicas de compuestos clorofluorocarbonados (CFC), con una contribución volcánica nula. La reacción vista con anterioridad refleja un ejemplo particular de acoplamiento de perturbaciones de origen humano y natural (volcánica), que puede ser mejorado con el tiempo mediante erupciones y explosiones volcánicas.
Existe un estudio reciente acerca de la composición del gas volcánico que forma la pluma del volcán de Pacaya, realizado por A, Battaglia en el 2017. En este estudio muestra un perfil gaseoso compuesto de 80.5% de vapor de agua, 10.4% de CO2 y 9.0% de SO2. Siendo Guatemala un país con una alta actividad volcánica, se deberían de realizar estudios para obtener un perfil de la composición gaseosa de las erupciones de los volcanes más activos, para poder establecer de qué forma podría afectar la atmosfera en nuestro país.
Bibliografía:
-
Jihong Cole-Dai, “Volcanoes and Climate”, Wiley Interdisciplinary Reviews Climate Change, November 2010.
-
Von Glasow, Roland, et al. “The Efects of Volcanic Eruptions on Atmospheric Chemistry”. Chemical Geology 263 (2009) 131–142.
-
Aiuppa, A., et al. “Halogens in Volcanic Systems”. Chemical Geology 263 (2009) 1–18.
-
Battaglia A., et al. “The magmatic gas signature of Pacaya Volcano, with implications for the volcanic CO2 flux from Guatemala. Geochemistry, Geophysics, Geosystems, 19, 667–692.
- Zielinski, G. “Climatic Impact of Volcanic Eruptions”. TheScientificWorldJOURNAL (2002) 2, 869884
Este artículo fue publicado en la revista de RELABSA









